Aminoácidos: Os tijolos das proteínas.
- Laura Cruz
- 16 de fev. de 2022
- 3 min de leitura
Há um ditado interessante, no qual diz "Toda proteína é um aminoácido, mas nem todo aminoácido é uma proteína". Acompanhe o post para saber mais.
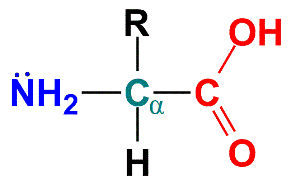
O aminoácido é a junção de um carbono central à um grupo amina (NH2), um grupo Ácido Carboxílico (COOH), um átomo de hidrogênio (H) e à um radical (R). A junção desses grupos irão formar o aminoácido. Há 20 tipos de aminoácidos, o que difere a uns dos outros são os seus radicais. Veja a figura abaixo todos os 20 aminoácidos com suas estruturas moleculares e nomenclaturas respectivamente.

Aminoácidos naturais e essenciais
Os aminoácidos são divididos em dois grandes grupos, os naturais e os essenciais. Os naturais são 12, caracterizado por serem produzidos pelo organismo humano, enquanto o essenciais que são total de 8 aminoácidos, são aqueles que são adquiridos através dos vegetais, estes que por sua vez produz todos os 20 aminoácidos. Por isto é necessário uma alimentação diversificada com vegetais, um exemplo é o tradicional arroz e feijão, esta combinação propicia a ingestão dos aminoácidos necessários ao organismo humano.
Os aminoácidos essenciais ao ser humano são fenilalanina, isoleucina, leucina, lisina, metionina, treonina, triptofano e valina. Ademais, alguns pesquisadores consideram arginina e histidina.

LIGAÇÕES PEPTIDICAS (A FORMAÇÃO DAS PROTEINAS)
A ligação entre dois aminoácidos ou mais são chamados de "ligações peptídicas", essas ligações são covalentes, e ocorre o agrupamento de um grupo amina de um aminoácido ao grupo carboxila do outro, ocorrendo a "síntese por desidratação", pois ocorre a liberação de água (H2O). Assim o Carbono (C) da hidroxila se une ao Nitrogênio (N) do grupo amina, se estabilizando e formando assim uma ligação dipeptídeo (dois aminoácidos).
Para alguns pesquisadores, as ligações peptídicas somente são consideradas proteínas a partir da ligação de 5 aminoácidos (pentapeptídeo), porém outros consideram a partir de 15 aminoácidos, mas no geral é mais considerado a partir de 5 aminoácidos. A albumina é formada por uma cadeia polipeptídica, enquanto a hemoglobina é formada por 4.

Esquema da síntese proteica (Ligação peptídica). Os átomos em vermelho são responsáveis por formar a molécula de água que será liberada (Processo de desidratação).

A estrutura molecular da albumina. (Estrutura quaternária).
CLASSIFICAÇÃO DO AMINOÁCIDOS
Polaridade (Hidrossolúveis e hidrofóbicos)
Os aminoácidos são definidos a partir da sua polaridade, através da sua cadeia lateral. São classificados em apolares (Hidrofóbicos) e polares (Hidrofílicos). Dependendo do meio ao qual está inserido as proteínas, que é compostas por estes aminoácidos, ocorre uma interação dos aminoácidos. Sendo que os aminoácidos apolares (hidrofóbicos) ficam na superfície interior, enquanto os polares (hidrofílicos) ficam na superfície mais externa.
Apolares (Hidrofóbicos)
Sua cadeia lateral é formada apenas por hidrocarbonetos, fazendo parte dessa classe:
L- Alanina
L-Fenilalanina
L- Isoleucina
L- Leucina
L- Metionina
L- Prolina
L- Triptofano
L- Valina
Polares (Hidrofílicos) Neutros
Sua cadeia lateral em geral é formada por grupos funcionais, que em contato com a água interagem entre si, formando pontes de hidrogênio.
Serina
L-treonina
L-cisteína
L-asparagina
L-tirosina
L-glutamina
Glicina
Polares (Hidrofílicos) ácidos
Nesta classe são os aminoácidos, apresentam radicais que possuem carga liquida negativa em pH (abaixo de 7,0), possuindo na sua lateral um grupo carboxila ionizado.
L- aspartato
L- glutamato
Polares (hidrofílicos) básicos
As classes dos polares básicos, são o oposto dos ácidos. Pois este apresenta radical com carga liquida positiva (acima de 7,0), possuindo sua cadeia lateral protonadas.
L- arginina
L- histidina
L- lisina
A nomenclatura/abreviatura dos aminoácidos na bioinformática
Na bioinformática, há um sistema com nomenclaturas ou abreviaturas para identificar os diversos aminoácidos. Estes podem ser representados por apenas uma letra. Siga a tabela abaixo para compreender a importância deste conhecimento.

REFERÊNCIAS
SERGIO, L. S. R. A química da vida. In: DIDÁTICOS, S. (Ed.). . Conecte biologia - Volume 1. São Paulo: [s.n.]. p. 244–245.
AMINOÁCIDOS | Curso Bioquímica Ens. Superior, Professor Rafael Barbosa (URL: https://www.youtube.com/watch?v=sY8Zw7rOve4&list=PLmtykM3ZLOU_l5gAVO4xNf41OmNSvzk4t&index=3)
A QUÍMICA DOS AMINOÁCIDOS E PEPTÍDEOS (URL: https://cesad.ufs.br/ORBI/public/uploadCatalago/11280916022012Bioquimica_aula_3.pdf)




Comentários